Farklı Sıvıların Yoğunlukları Neden Değişir?
Sıvıların yoğunluğu, belirli bir sıcaklık ve basınç altında birim hacimde bulunan kütle miktarını ifade eden önemli bir fiziksel özelliktir. Yoğunluk, birçok faktör tarafından etkilenebilir ve bu durum farklı sıvıların yoğunluklarının neden değiştiğini anlamak için kritik öneme sahiptir. Bu makalede, sıvıların yoğunluğunu etkileyen başlıca faktörler incelenecektir.
1. Sıvının Kimyasal Yapısı
- Sıvıların kimyasal bileşimi, moleküler yapıları ve atomik ağırlıkları, yoğunluk üzerinde doğrudan etkili olan en temel unsurlardır.- Örneğin, su (H₂O) ve alkol (C₂H₅OH) moleküllerinin yapısı ve atomik ağırlıkları, bu sıvıların yoğunluklarının farklı olmasına neden olur.- Su, 20 °C'de yaklaşık 1 g/cm³ yoğunluğa sahipken, etanolün yoğunluğu yaklaşık 0.789 g/cm³'tür. Bu, suyun daha fazla kütle içeren daha ağır bir sıvı olduğunu gösterir.
2. Sıcaklık ve Basınç Etkisi
- Sıcaklık, bir sıvının yoğunluğunu etkileyen önemli bir faktördür. Sıcaklık arttıkça, sıvı moleküllerinin kinetik enerjisi artar ve bu da moleküllerin daha fazla hareket etmesine ve sıvının hacminin genişlemesine neden olur.- Bu genişleme, yoğunluğun azalmasına yol açar. Örneğin, suyun yoğunluğu 4 °C'de en yüksektir ve sıcaklık arttıkça yoğunluğu düşer.- Basınç da sıvıların yoğunluğunu etkileyebilir, ancak genellikle sıvılar, gazlara göre basınca karşı daha az duyarlıdır. Yüksek basınç altında sıvıların yoğunluğu artabilir, çünkü moleküller arasındaki boşluklar azalır.
3. Moleküler Etkileşimler
- Moleküller arası etkileşimler, sıvıların yoğunluğunu etkileyen bir diğer önemli faktördür. Polar ve apolar moleküller arasındaki farklı etkileşimler, sıvının yoğunluğunu etkileyebilir.- Örneğin, su gibi polar sıvılar, hidrojen bağları sayesinde yüksek yoğunluklara sahipken, yağ gibi apolar sıvılar daha düşük yoğunluklara sahiptir.- Moleküller arası etkileşimler, sıvıların fiziksel özelliklerini belirlemede kritik bir rol oynamaktadır.
4. Çözücü ve Çözücü Özellikleri
- Çözücü özellikler, bir sıvının içinde diğer maddelerin çözünmesi ile ilgili olarak, yoğunluğu etkileyen önemli bir faktördür.- Örneğin, tuzlu su, saf suya göre daha yüksek bir yoğunluğa sahiptir, çünkü tuz molekülleri suyun arasına girdiğinde, toplam kütleyi artırırken hacmi daha az artırır.- Bu durum, çözeltinin yoğunluğunu artırır.
5. Sıvıların Fiziksel Durumu
- Sıvıların fiziksel durumu, yani sıvının homojenliği ve içindeki gaz kabarcıkları gibi faktörler de yoğunluğu etkileyebilir.- Örneğin, bir sıvının içinde gaz kabarcıkları varsa, bu durum sıvının yoğunluğunu azaltabilir.- Homojen bir sıvı, heterojen bir sıvıya göre daha tutarlı bir yoğunluğa sahip olma eğilimindedir.
Sonuç
Farklı sıvıların yoğunlukları, kimyasal yapıları, sıcaklık ve basınç koşulları, moleküler etkileşimler, çözücü özellikler ve fiziksel durum gibi çeşitli faktörlerden etkilenmektedir. Bu faktörlerin her biri, sıvıların yoğunluğunu belirlemede önemli bir rol oynamakta ve sıvıların özelliklerini anlamamızda yardımcı olmaktadır. Yoğunluk, birçok bilimsel ve endüstriyel uygulamada kritik bir parametre olduğundan, sıvıların yoğunluğunu etkileyen bu faktörlerin detaylı bir şekilde incelenmesi önem taşımaktadır.
|






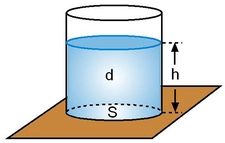
.webp)













.webp)








Sıvıların yoğunluklarının neden bu kadar farklı olduğunu merak ediyorum. Kimyasal yapıların etkisi elbette önemli, ama sıcaklık ve basınç faktörlerinin de yoğunluğu nasıl etkilediği hakkında daha fazla bilgi almak isterim. Moleküller arası etkileşimlerin yoğunluk üzerindeki rolü de dikkatimi çekiyor. Özellikle polar ve apolar moleküllerin yoğunluk farklarını daha iyi anlamak, sıvıların fiziksel özelliklerini incelemek açısından faydalı olabilir. Ayrıca, çözücü özelliklerin sıvıların yoğunluğuna etkisinin pratikte nasıl gözlemlendiğini merak ediyorum. Bu konuda daha fazla örnek ve açıklama paylaşabilir misiniz?
Meriç Bey, sıvıların yoğunluk farklılıkları konusundaki detaylı sorunuz için teşekkür ederim. Yoğunluk, sıvıların kütlelerinin hacimlerine oranıdır ve bu değeri etkileyen birçok faktör bulunur. İşte istediğiniz konulara dair açıklamalar:
Sıcaklık ve Basınç Etkisi
Sıcaklık arttıkça, sıvı molekülleri daha fazla kinetik enerji kazanır ve genleşir, bu da hacmin artmasına ve yoğunluğun azalmasına yol açar. Örneğin, suyun yoğunluğu 4°C'de maksimumken, ısındıkça azalır. Basınç artışı ise sıvıları sıkıştırarak hacmi küçültür ve yoğunluğu artırır, ancak sıvılar sıkıştırılamaz kabul edildiğinden bu etki gazlara göre daha az belirgindir. Pratikte, derin okyanuslarda yüksek basınç altında suyun yoğunluğu hafifçe artar.
Moleküller Arası Etkileşimler
Moleküller arası kuvvetler (hidrojen bağları, van der Waals kuvvetleri gibi) yoğunluğu doğrudan etkiler. Güçlü etkileşimler, molekülleri daha yakın paketlenmeye zorlayarak yoğunluğu artırabilir. Örneğin, suda hidrojen bağları nedeniyle moleküller sıkı paketlenir, bu da yüksek yoğunluğa katkıda bulunur.
Polar ve Apolar Moleküllerin Yoğunluk Farkları
Polar moleküller (su gibi) genellikle daha yüksek yoğunluğa sahiptir çünkü dipol-dipol etkileşimleri veya hidrojen bağları molekülleri bir arada tutar. Apolar moleküller (benzin veya yağ gibi) ise daha zayıf London kuvvetleri nedeniyle daha düşük yoğunluk gösterir. Örneğin, suyun yoğunluğu ~1 g/mL iken, benzinin ~0.7 g/mL'dir; bu fark, polaritenin yoğunluk üzerindeki rolünü vurgular.
Çözücü Özelliklerin Pratik Gözlemi
Çözücülerin yoğunluğu, karışımlarda tabakalaşmaya neden olabilir. Petrol sızıntılarında, suyun üzerinde yağın yüzmesi, apolar yağın düşük yoğunluğundan kaynaklanır. Ayrıca, alkol-su karışımlarında yoğunluk değişimi, moleküler etkileşimlerin karmaşıklığını gösterir; örneğin, etanolün yoğunluğu sudan düşüktür, bu da karışımın yoğunluğunu azaltır.
Özetle, yoğunluk, kimyasal yapı, sıcaklık, basınç ve moleküler etkileşimlerin bir bileşenidir. Daha fazla örnek veya detay isterseniz, memnuniyetle paylaşırım.